L’energia chimica è contenuta nei diversi tipi di legami tra gli atomi di una molecola. Essi possono essere legami forti (ionici, covalenti) oppure legami deboli (legami idrogeno, forze intermolecolari..). All’interno di una cellula vi è un continuo susseguirsi di reazioni che producono (esoergoniche) o utilizzano energia (endoergoniche). Una delle molecole fondamentali per gli scambi energetici è l’ATP, che libera energia attraverso il trasferimento di un gruppo fosfato ad un'altra molecola. Questa reazione, insieme ad altre reazioni, tra cui quelle di ossido-riduzione, contribuisce a fornire l’energia necessaria per la vita delle cellule. Tutti questi processi legati tra loro, in cui le molecole vengono sintetizzate o idrolizzate, prendono il nome di metabolismo.
L'atomo è composto principalmente da tre tipologie di particelle subatomiche (cioè di dimensioni minori dell'atomo): i protoni, i neutroni e gli elettroni. I protoni (carichi positivamente) e i neutroni (privi di carica) formano il "nucleo" (carico positivamente); gli elettroni (carichi negativamente) sono presenti nello stesso numero dei protoni e ruotano attorno al nucleo senza seguire un'orbita precisa (l'elettrone si dice quindi "delocalizzato"), rimanendo confinati all'interno degli orbitali (o "livelli energetici") (Figura 1).
figura 1 - Atomo
Si definisce legame chimico la forza attrattiva che si stabilisce tra due o più atomi, uguali o diversi, permettendo loro di interagire a formare molecole o aggregati cristallini (Figura 2).

figura 2 - Molecola
I fondamenti della teoria elettronica del legame chimico si rifanno al modello di G.N. Lewis (1875-1946). Lewis concluse che la presenza all’esterno di otto elettroni, doveva essere considerata una condizione particolarmente stabile, alla quale tendono gli atomi di tutti gli elementi. In base a queste considerazioni, egli stabilì la regola dell’ottetto (Figura 3), secondo la quale ogni atomo, in base al numero di elettroni esterni di valenza, tende a cedere, acquistare o mettere in comune gli elettroni necessari al completamento del guscio elettronico esterno, per raggiungere in questo modo la configurazione elettronica del gas nobile più vicino.

figura 3 - Regola dell'ottetto
Tipi di legame
Possiamo classificare i legami chimici secondo diversi modelli che dipendono dal tipo di atomi coinvolti nel legame.
Il legame ionico, si forma tra specie di accentuata differenza di elettronegatività. Si verifica il trasferimento di uno o più elettroni dall'atomo meno elettronegativo (che perdendo elettroni diventa uno ione positivo = catione) all’atomo più elettronegativo (che acquistando elettroni diventa uno ione negativo = anione). Sono molecole formate da legami ionici NaCl, KCl, Na2SO4, KClO3. Nel cloruro di sodio, ad esempio, lo ione Na+ si circonda di 6 ioni Cl- e lo ione Cl- si circonda di 6 ioni Na+. Si forma il reticolo cristallino cubico di NaCl (Figura 4), cioè una struttura solida ordinata in cui gli ioni di carica opposta si alternano ordinatamente nelle tre direzioni dello spazio.

figura 4 - Reticolo cristallino di NaCl
Il legame covalente si realizza con la condivisione di una o più coppie (doppietti) di elettroni da parte di due atomi, che acquistano una configurazione elettronica esterna stabile (ottetto). Esistono due tipi di legame covalente: il legame covalente puro, tra atomi dello stesso elemento (per esempio H2) e il legame covalente polare, tra atomi di elementi diversi. Nel secondo caso la coppia di elettroni sarà attratta dall’atomo più elettronegativo, che acquisterà una parziale carica negativa (δ-), bilanciata da una parziale carica positiva (δ+) sull’atomo meno elettronegativo. La molecola costituisce un dipolo elettrico (per esempio la molecola HCl, Figura 5, o la molecola di acqua, H2O).

figura 5 - HCl
I legami deboli includono le interazioni tra molecole, sia polari sia apolari, e comprendono: le interazioni dipolo/dipolo, le interazioni tra molecole non polari (genericamente indicate come forze di van der Waals), il legame a idrogeno, che, per esempio, tiene unite le molecole di acqua tra loro (Figura 6).

figura 6 - Legame idrogeno
Energia per le cellule
La luce solare è la fonte di tutta l’energia biologica. Essa viene convertita in energia chimica dalle piante, da alcune alghe e alcuni batteri. Questa energia chimica è racchiusa nelle molecole e viene trasferita mediante la creazione e la distruzione di legami chimici. I trasferimenti di energia che avvengono nelle cellule utilizzano un flusso di elettroni che va da una molecola a un’altra che abbia un potenziale elettrochimico più basso. Tutte le reazioni in cui si ha un flusso di elettroni sono reazioni di ossido-riduzione. In queste reazioni uno dei reagenti viene ossidato (perde elettroni) mentre un altro viene ridotto (acquista elettroni).
Le reazioni chimiche possono essere accoppiate in modo che una reazione che rilascia energia favorisca un'altra reazione che richiede energia. Le reazioni chimiche nei processi chiusi procedono spontaneamente fino a che non raggiungono l’equilibrio. Quando un sistema è all’equilibrio, la velocità di formazione dei prodotti diventa uguale a quella in cui i prodotti stessi si trasformano in reagenti. La variazione di energia che si ha quando un sistema passa da uno stato iniziale a quello di equilibrio, viene chiamata variazione di energia libera, ∆G. Ogni composto coinvolto in una reazione chimica contiene una certa quantità di energia potenziale, dovuta al tipo e dal numero dei legami chimici presenti. Nelle reazioni che avvengono spontaneamente, i prodotti possiedono meno energia libera dei reagenti, quindi la reazione rilascia energia (esoergonica). Le reazioni endoergoniche richiedono invece un rifornimento di energia libera. L’accoppiamento delle reazioni esoergoniche con quelle endoergoniche è uno degli aspetti essenziali negli scambi energetici delle cellule.
Il meccanismo di base di questi accoppiamenti energetici nelle reazioni biologiche agisce sempre attraverso un intermedio condiviso. La demolizione dell’adenosina trifosfato (ATP, Figura 7) è la reazione esoergonica che favorisce molti dei processi endoergonici delle cellule.
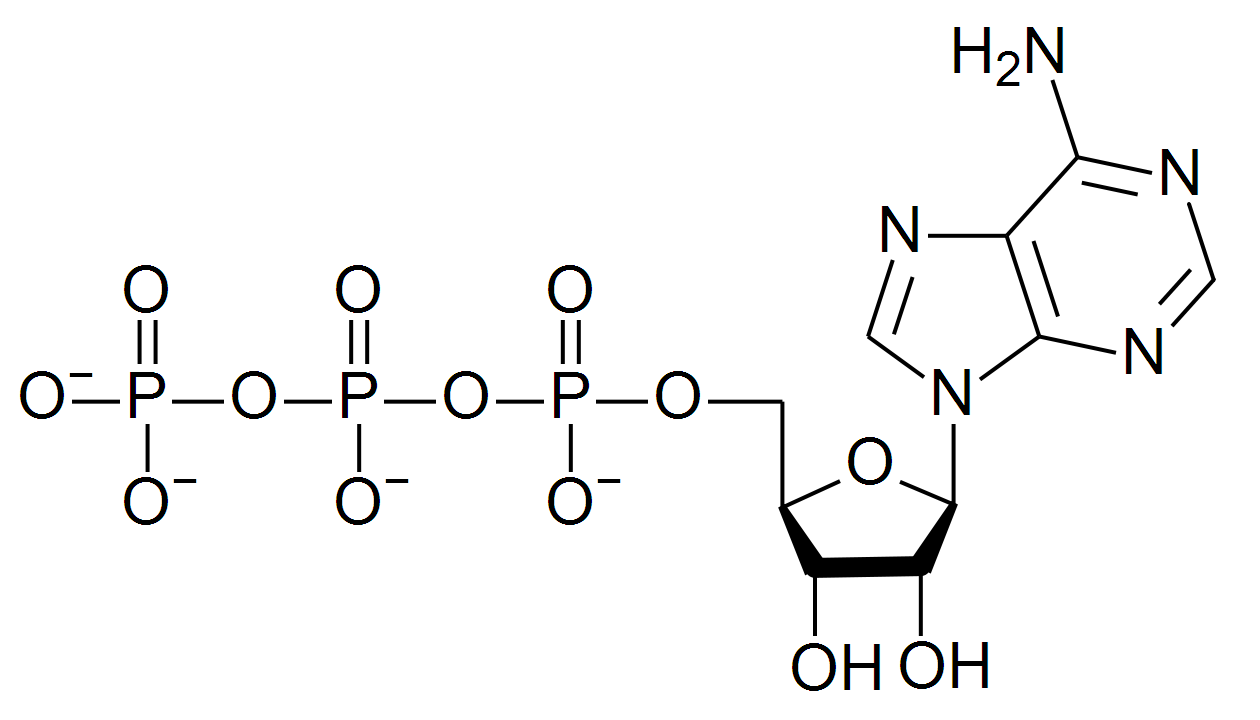
figura 7 - ATP, adenosintrifosfato
ATP, adenosintrifosfato

Atomo
Rappresentazione schematica di un atomo di elio. Attorno al nucleo, composto da due neutroni (in verde) e due protoni (in rosso), ruotano gli elettroni (in giallo).
Molecola
Modello molecolare dell’ormone vasopressina elaborato al computer. I legami tra gli atomi sono indicati dalle linee piane. Da: http://www.federica.unina.it/agraria/fondamenti-di-chimica-generale-ed-inorganica/legame-chimico-covalente/

Regola dell'ottetto
Rappresentazione degli elettroni dei primi elementi della tavola periodica secondo la regola dell’ottetto di Lewis. Da: http://www.federica.unina.it/agraria/fondamenti-di-chimica-generale-ed-inorganica/legame-chimico-covalente/

Reticolo cristallino di NaCl

HCl
Legame covalente polare nella molecola HCl. Da: http://www.federica.unina.it/agraria/fondamenti-di-chimica-generale-ed-inorganica/legame-chimico-covalente/

Legame idrogeno
Rappresentazione del legame idrogeno che si instaura tra più molecole di acqua

Le cellule e gli organismi hanno bisogno di un continuo apporto di energia per contrastare l’inesorabile tendenza di un sistema a decadere a stati energetici sempre più bassi. La conservazione e l’espressione dell’informazione costano energia, le reazioni di sintesi cha avvengono all’interno delle cellule richiedono energia. L’energia che regge tutto il sistema è quella solare; grazie ad essa le piante possono crescere e produrre sostentamento per gli altri organismi. Senza l’energia non ci sarebbe la vita.
De Robertis, Saez, De Robertis Jr. Gli enzimi, il metabolismo cellulare e la bioenergetica. Capitolo 4: 42-56. In: Biologia della cellula. Edizioni Zanichelli 1977
Il legame chimico, Università di Roma
La logica molecolare della vita. Capitolo 1: 3-19
Legame chimico covalente, Fondamenti di chimica generale e inorganica. Federica Web Learning, Università degli Studi di Napoli Federico II.
Legami chimici, Parte prima. Treccani.
Nelson D.L. e Cox M.M I principi di biochimica di Lehninger. Ed. Zanichelli, 2002.




